احتراق عناصر سوخت با اکسیژن هوا
احتراق ناقص
احتراق با هوای اضافی
آنالیز محصولات احتراق
تعیین درصد جرمی عناصر در محصولات احتراق
نقطه شبنم محصولات احتراق
درس ششم: آنالیز ترموشیمیایی احتراق
گرمای ویژه محصولات احتراق و تغییرات آن با درجه حرارت
ارزش حرارتی سوخت ها
دمای شعله آدیاباتیک (Adiabatic)
تعادل شیمیایی فرایندهای احتراق
ضریب ثابت تعادل
جداول و نمودارهای احتراق
درس هفتم: مکانیزم تحول احتراق
مختصری از مسائل عملی احتراق
تئوری سینتیک شیمیایی
تئوری واکنش زنجیره ای انتشار شعله
شعله های دیفیوژن و هموژن
درس هشتم: مشعل ها
مشعل های گازی
مشعل های سوخت مایع
مشعل های فشاری
مشعل های گریز از مرکز
مشعل های تبخیری
احتراق در موتورهای داخلی
احتراق در کوره ها و نیروگاه ها
ازمایشگاهم احتراق میکرو و مزو دستگاه آزمایش محفظه احتراق در شرایط اتمسفریک و دستگاه آزمایش محفظه چرخش دو گانه و دستگاه آزمایش بررسی اثر چرخش دستگاه آزمایش شعله دیفیوژن و دستگاه آزمایش شعله MILDو دستگاه آزمایش بررسی جرقه و aouto ignitionو دستگاه آزمایش counter-flow که قبلا گذروندم واقعا جذابه
تا جایی که میدونم هیدروکربن های سنگین مخلوط ناهمگنی از ترکیباتند که از آلکیله و رزین ها و آسفالتین ها تشکیل شدن
این هیدروکربن مثل گازوئیل یا سوخت دیزل هم میگن و در محدوده C14 تا C25 جای داره. همچنین گروه های عاملی این محصول پارافینیک، نفتنیک و آروماتیک ها میباشند که گرانروی آن ها تقریبا 840kg/m3 هست.احتراق هیدروکربنها اونچه خوندم $C_xH_y + N(O_2)\leftrightarrow x(CO_2) + \frac{y}{2} (H_2O)$
اگر احتراق استوکیومتری با استفاده از هوا به عنوان منبع اکسیژن انجام بشه نیتروژن موجود در هوا را میتوان به معادله اضافه کرد تا ترکیب استوکیومتری سوخت در هوا و ترکیب را نشان دهد. از گاز دودکش حاصل در نظر گرفتن تمام اجزای غیر اکسیژن هوا به عنوان نیتروژن نسبت نیتروژن به اکسیژن 3.77 هستش یعنی (100٪ - O2٪ / O2٪ که در آن O2٪ 20.95٪ حجمه
${\displaystyle {\ce {C}}_{x}{\ce {H}}_{y}+z{\ce {O2}}+3.77z{\ce {N2 ->}}\ x{\ce {CO2}}+{\frac {y}{2}}{\ce {H2O}}+3.77z{\ce {N2}}}
$
کلی ${\displaystyle {\ce {C_{\mathit {\alpha }}H_{\mathit {\beta }}O_{\mathit {\gamma }}}}+\left(\alpha +{\frac {\beta }{4}}-{\frac {\gamma }{2}}\right)\left({\ce {O_{2}}}+3.77{\ce {N_{2}}}\right)\longrightarrow \alpha {\ce {CO_{2}}}+{\frac {\beta }{2}}{\ce {H_{2}O}}+3.77\left(\alpha +{\frac {\beta }{4}}-{\frac {\gamma }{2}}\right){\ce {N_{2}}}}
$
در چرخه برایتون که من میخونم محصولات احتراق گازی با فشار و دمای بالا مستقیماً وارد یک توربین گاز میشوند که بخشی از آنتالپی آنها به کار شفت تبدیل میشه.
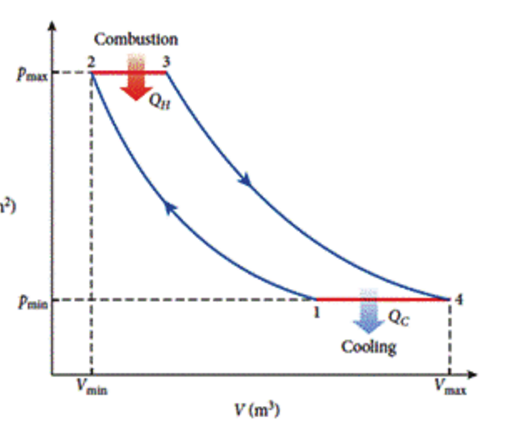
بازده سیکل برایتون $\eta = \frac{C_p(T_3-T_4) - C_p(T_2-T_1)}{C_p(T_3-T_2)}$
.4 نوع هیدروکربن داریم
. چهار دسته اصلی هیدروکربن ها وجود داره آلکان ها، آلکن ها، آلکین ها و هیدروکربن های معطر.

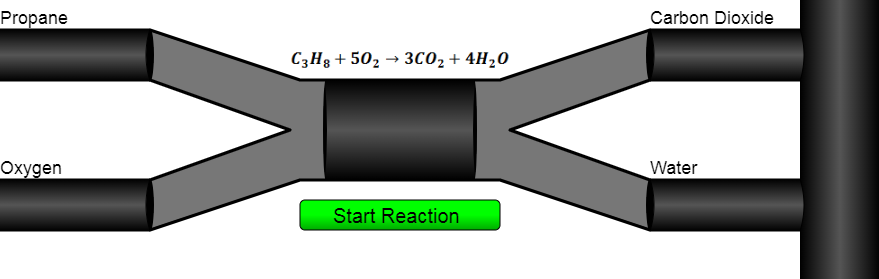
محصولات حاصل از احتراق هیدروکربن ها دی اکسید کربن و آبه. بسیاری از هیدروکربن ها به عنوان سوخت استفاده میشن چون احتراقشون مقدار بسیار زیادی انرژی گرمایی آزاد میکنه. پروپان (C3H8) یک هیدروکربن گازیه که معمولاً به عنوان منبع سوخت در کوره های گاز استفاده میشه.سوخت جت هم عموما از هیدروکربن های آلیفاتیک و آروماتیک با محدوده جوش 150-300 درجه سانتی گراد و 45-280 درجه سانتی گراده

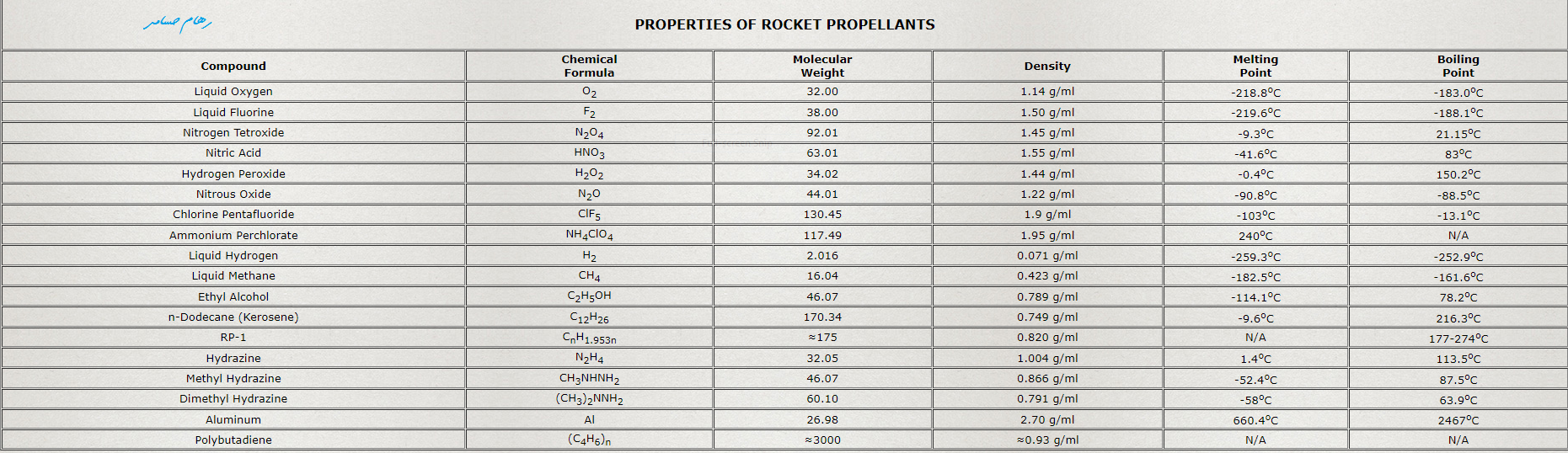
RP-1 (به طور متناوب،Rocket Propellant-1 یا Refined Petroleum-1) یک شکل بسیار تصفیه شده نفت سفیده که ظاهراً شبیه سوخت جته که به عنوان سوخت موشک استفاده میشه. RP-1 یک تکانه ویژه کمتر از هیدروژن مایع (LH2) ارائه میده اما ارزونتره در دمای اتاق پایداره و خطر انفجار کمتری را ارائه میده
واکنش سوختن نفت سفید $2 \mathrm{C} _ {12} \mathrm{H} _ {26} (I)+37 \mathrm{O} _{2}(g) \rightarrow 24 \mathrm{C O}_{2}(g)+26 \mathrm {H}_{2} \mathrm{O} (g) \; \Delta H^ {*}=-7513 \mathrm {~kJ}$
یک هواپیما چقدر دی اکسید کربن تولید میکنه این معادله 2 C8H18 + 25 O2 -> 16 CO2 + 18 H20. هر گالن JP8 - نفت سفید - یا سوخت جت، حدود 6.5 پوند وزن داره. یک گالن با 23 پوند اکسیژن ترکیب میشه و بیست پوند CO2 تولید میکنه..
واکنش شیمیایی استوکیوتری سوختن هیدروکربن :${\displaystyle C_{x}H_{y}+\left(x+{\frac {y}{4}}\right)O_{2}\rightarrow \;xCO_{2}+\left({\frac {y}{2}}\right)H_{2}O}$
آتش توسط یک واکنش اکسیداسیون گرمازا ایجاد میشود$\text{C}_n\text{H}_m(s) + \frac{4n+m}{4}\text{O}_2(g) \to n\text{CO}_2(g) + \frac{m}{2}\text{H}_2\text{O}(g)+\Delta H$
معادله دیفرانسیل نرخ سوخت هواپیما
هواپیماها زمانی که سوخت بیشتری دارند عملکرد بدتری دارند
$\begin{equation}
\dot{\phi}=\rho-\lambda\phi\mathrm{,}
\end{equation}$جایی که ϕ مقدار سوخت دانسبته ρ و λ ثابته $\begin{equation}
\phi(t)=\left(\phi(0)-\frac{\rho}{\lambda}\right)e^{-\lambda t}+\frac{\rho}{\lambda}\mathrm{.}
\end{equation}$ و$\begin{equation}
\frac{d\phi}{dt}=-\lambda\phi\iff\frac{d\phi}{\phi} = -\lambda dt \implies \log\phi(t)=-\lambda t + K\implies \phi(t)=e^K e^{-\lambda t}
\end{equation}$یک روش معمول این است که معادله همگنه ببینید $\phi=\frac \rho \lambda, \dot \phi =0$
$\phi(t)=\frac \rho \lambda + e^Ke^{-\lambda t}$ است
محاسبه کسر جرمی مخلوط گاز هیدروژن و اکسیژن قبل از احتراق
من سعی می کنم کسر جرمی مخلوط گاز هیدروژن اکسیژن را به عنوان تابعی از نسبت هم ارزی قبل از احتراق محاسبه کنم.
نسبت هم ارزی
$\phi=\frac{FA}{FA_s}=\frac{\frac{m_f}{m_{air}}}{\frac{m_{fs}}{m_{air,s}}}=\frac{\frac{n_f}{n_{air}}}{\frac{n_{fs}}{n_{air,s}}}$
در جایی که FA نسبت سوخت به هواست و یک s مخفف واکنش استوکیومتری است.
معادله واکنش احتراق متعادل (با فرض یک مخلوط کاملاً استوکیومتری)
$2H_2+1O_2\rightarrow2H_2O$
بنابراین $n_{fs} = 2$و $n_{air,s}=1$. حالا، وقتی کسرهای جرمی را تابعی از نسبت هم ارزی می نویسم، کار من این است:
$y_{O_2}=\frac{m_{air}}{m_f+m_{air}}=\frac{1}{FA+1}=\frac{1}{\phi\frac{n_{fs}}{n_{air,s}}+1}=\frac{n_{air,s}}{\phi n_{fs}+n_{air,s}}=\frac{1}{2\phi+1}$
با یک محاسبه مشابه:$y_{H_2}=\frac{n_{fs}\phi}{n_{fs}\phi+n_{air,s}}=\frac{2\phi}{2\phi+1}$
یک بررسی سریع که باید درست باشه نشون میده که$y_{H_2}+y_{O_2}=1$
دلیل اینکه من در مورد این محاسبه می پرسم این است که من این محاسبه را برای پروژه قبلی انجام دادم و نتایجی که تو کلاس درسم بحث شد صحیحه برعکس بود (یعنی عبارت ϕ در صورت حساب برای $y_{O_2}$ بود نه$y_{H_2}$. آیا چیزی وجود داره که من اشتباه انجام داده باشم. /آیا من آنها را اشتباه محاسبه کردم؟$\phi=\frac{FA}{FA_s}=\frac{\frac{m_f}{m_{air}}}{\frac{m_{fs}}{m_{air,s}}}=\frac{\frac{n_f}{n_{air}}}{\frac{n_{fs}}{n_{air,s}}}$
32 افزایش مییابد زیرا جرم مولی O2 به دلایلی در عبارت بود
من علت اشتباه خود را کشف کرده ام. ببینید
$\phi=\frac{FA}{FA_s}=\frac{\frac{m_f}{m_{air}}}{\frac{m_{fs}}{m_{air,s}}}=\frac{\frac{n_f}{n_{air}}}{\frac{n_{fs}}{n_{air,s}}}$
به خودی خود درست است، اما این بدان معنا نیست که $FA_s=\frac{n_{fs}}{n_{air,s}}$این فرض را بعد از اینکه جرم های مولی را که برای تبدیل تودهها استفاده میشد حذف کردم در ذهنم ایجاد کردم.
عبارات صحیح $y_{O_2} = \frac{n_{o,s}M_O}{\phi n_{f,s}{M_f}+n_{o,s}M_O}$
و$y_{H_2} = \frac{\phi n_{f,s}M_f}{\phi n_{f,s}{M_f}+n_{O,s}M_O}$
استخراج معادله $FA = \phi n_{fs}/n_{O2s}$ اشتباه دارد. اصلاح اینجاست. برای سادگی، من از F به جای FA، mO و nO به ترتیب به عنوان جرم و مول برای O2 و یک ⋆ برای استوکیومتری استفاده میکنم. من از عبارت ω برای کسر جرمی و M (M مایه) برای جرم مولی استفاده می کنم.$\phi \equiv \frac{F}{F_s} = \frac{m_f/m_O}{m^\star_f/m^\star_O}$
$\omega_O \equiv \frac{m_O}{m_f + m_O} = \frac{1}{F + 1}$
$F = \phi\ F_s = \phi\ \frac{m^\star_f}{m^\star_O} = \phi\ \frac{n^\star_f\ M_f}{n^\star_O\ M_O}$
برای واکنش داده شده، $n^\star_f = 2$ و $n^\star_O = 1$. از این رو
$\omega_O = \frac{1}{2\phi M_{f/O} + 1}$
که در آن $M_{f/O}$ نسبت جرم مولی سوخت (H2) به اکسیژن O2 است.
عبارت ωf از موازنه جرم$\omega_O + \omega_f = 1$ بدست می آید.
کسر مولی مخلوط قبل از احتراق چقدر است؟اگر هر دو ترکیب با نسبت استوکیومتری با O2 واکنش دهند، کسر مولی C2H6/C3H8 در مخلوط چقدر است؟ جرم CO2 تولید شده 1.819 برابر بزرگتر از جرم H2O است.
$\ce{C2H6_{(g)} + O2_{(g)} -> CO2_{(g)} + H2O_{(g)}}$
$\ce{C3H8_{(g)} + O2_{(g)} -> CO2_{(g)} + H2O_{(g)}}$
من معادلات را متعادل کردم و موارد زیر را امتحان کردم:
$\frac{X4M(CO_2)+(X-1)4M(CO_2)}{X8M(H_2O)+(X-1)6M(H_2O)}=1.819$که من را به نتیجه اشتباهی رساند.
همیشه مفید است که تا آنجایی که میتوانید کار را نشان دهید تا بتوانیم ببینیم کجا از مسیر خارج شدین دوباره نگاه کنید و انالیز کنین
ابتدا باید معادلات متعادل را بنویسیم
$\begin{aligned}
\ce{&C2H6(g) + $3.5$~ O2(g) -> 2 CO2(g) + 3 H2O(g)} \\
\ce{&C3H8(g) + 5 O2(g) -> 3 CO2(g) + 4 H2O(g)}
\end{aligned}$دوم به ما داده شده
جرم (CO2) = 1.819 جرم (H2O)
می توانیم این را به نسبت مولی تبدیل کنیم
$\ce{\frac{[mass ~(CO2)]}{[$44.009$]}~=~ $1.819$ * \frac{[mass~ (H2O)]}{[$18.015$]}}$
و متوجه می شویم که نسبت مولی از
$\ce{\frac{[moles~(CO2)]}{[moles~(H2O)]}~=~ $0.744604$}$اکنون فقط برای درک چیزها بیایید به مورد اتان نگاه کنم و میبینیم که نسبت مول CO2 / H2O 2/3 داریم، در حالی که در مورد پروپان این نسبت 3/4 است. نسبت مولی مشاهده شده 0.74 نشان میدهد که واکنش پروپان عامل اصلی است. می تونم یک معادله کلی بنویسم
$\ce{\frac{[2/3 + (r * 3/4)]}{[1+r]}~=~$0.744604$}$
که در آن "r" نسبت مولی پروپان به اتان سوزانده شده است. حل برای "r" بازده$\ce{r~=~$13.59$}$پس $\ce{moles~\frac{[C2H6]}{[C3H8]}~=~ \frac{[1]}{[$13.59$]}}$
چگونه می توانم گرمای ویژه گازها را برای محاسبات موتور توربوجت تعیین کنم؟
من در یک آزمایشگاه احتراق هستم و در حال انجام آزمایشات روی یک موتور توربوجت هستیم. با این حال، من در محاسبه سرعت خروج و قدرت کمپرسور/توربین موتور مشکل دارم.
خروجی نازل را در نظر میگیرم جایی که گازهای خروجی اگزوز میروند. با فرض 100% راندمان آدیاباتیک نازل و اعمال قانون اول ترمودینامیک
$\frac{u_e^2}{2} = h_{0e}-h_e = c_{p,N}(T_{0e}-T_e)=c_{p,N}T_{0e}[1-(p_a/p_{0e})^{(\gamma_n - 1)/\gamma_n}],$با فرض pe=pa
، فشار محیط در آزمایشگاه، ما ترموکوپل هایی را راه اندازی کرده ایم که دما و فشار راکد در خروجی و همچنین شرایط محیط را اندازه گیری می کنند. مشکل من، با این حال، این است که من نمی دانم از کجا باید cp,N را دریافت کنم
، گرمای ویژه گازهای موجود در نازل از. من در یک کتاب مرجع جستجو کردم که میانگین نسبت گرمای ویژه γn=1.36 است
، اما این هنوز گرمای خاصی را که نیاز دارم به من نمی دهد زیرا من ثابت گاز خاص R را نمیدانم
برای این گازها برای مرجع، این یک توربوجت SR-30 با سوخت جت A است.در ضمن من در محاسبه خروجی های برق همین مشکل را دارم. با فرض اینکه تمام نیروی توربین به کمپرسور منتقل می شود،
$\dot{W_T} = (\dot{m_a} + \dot{m_f})c_{p,T}(T_{04}-T_{05})=\dot{m_a}c_{p,C}(T_{03}-T_{02}) = \dot{W_C}$باز هم، من هیچ سرنخی ندارم که گرمای ویژه چیه فقط نسبت آنها. آیا راهی وجود داره که بتوانم این مقادیر را محاسبه کنم یا آنها را در جایی جستجو کنم؟ یا حتی ثابت های خاص گاز را در جایی پیدا کنم؟
R یا R* ثابت گاز جهانی، 8.3143 ژول/K-mol است. ثابت گاز r برای یک گاز خاص، یا ثابت گاز خاص به صورت r = R/m محاسبه می شود که m وزن مولکولی گاز مورد نظر است.
مقادیر شناخته شده مورد استفاده در محاسبات توربین گاز دستی برای گرمای ویژه هوا 1005 J/kg/K و 1150 J/kg/K برای گازهای حاصل از احتراقه. با این حال، توجه دارم که این مقادیر انتخابی هستند که برای محاسبه مناسبند این مقادیر در هنگام در نظر گرفتن گازهای واقعی هیچ ارزشی ندارن
گرمای ویژه (در فشار ثابت، cp ) گازها به ترکیب و دما بستگی داره. این بدان معنیه که محاسباتم همیشه با استفاده از فرمول های بیان شده در معادله نادرسته. من باید در فرآیند فشرده سازی یا انبساط یکپارچه کنم
محاسبه گرمای خاص ممکنه توجه داشته باشید چگونه می توان این کار را از طریق یک برنامه کامپیوتری انجام داد برنامه کامپیوتری برای محاسبه ترکیبات و کاربردهای تعادل شیمیایی پیچیده، معروف به CAE.
ما معمولا شبیه سازی جریان های احتراقی در نرمافزار CEA انجام میدیم وشبیه سازی منیفولد دود موتور احتراقی با نرم افزار فلوئنت
این محاسبه بر اساس چند جملهای که مشارکتهای فردی را برای گونهها در گازها محاسبه میکند (برای بیبعد کردن چند جملهای، به شکل $\frac{C_p}{R}$داده میشود.
$\frac{c_p(T)}{R} = a_1T^{-2} + a_2T^{-1} + a_3 + a_4T + a_5T^{2} + a_6T^{3} + a_7T^{4}$
در این معادله ثابت های a1 از طریق a7 در زیر و بالاتر از 1000 K تعریف شده یافت شده با استفاده از این معادله در (J/mole/K) است. برای دریافت cp در (J/kg/K)، می توان از وزن مولی گونه استفاده کرد. cp یک مخلوط با گرفتن میانگین وزنی بین مقادیر cp محاسبه میشه از گونه های موجود در مخلوط در صورت cp در (J/kg/K) کسر جرمی باید استفاده شود و در صورت cp
در (J/mole/K) کسر مولی:$c_{pg} = \sum_{i=1}^{NS} ({m_i \cdot c_{p,i}}) = 1$
جایی کهcpg = گرمای ویژه در فشار ثابت محیط (گاز) (J/kg/K)NS = تعداد گونه های مخلوط و کسر جرمی گونه i وcp,i
= گرمای ویژه در فشار ثابت گونه (J/kg/K وگرمای ویژه مورد استفاده در نرم افزار شبیه سازی عملکرد توربین گاز بر اساس نسبت سوخت به هوا (FAR) نفت سفید در هوا جدول بندی می شود. با استفاده از درون یابی مقادیر مربوط به محاسبه پیدا میشود.CEA(Chemical Equilibrium with Applications


