اصل Aufbau (که اصل ساختن یا قانون Aufbau نیز نامیده می شود) بیان می کند که در حالت پایه یک اتم یا یون، الکترون ها قبل از اشغال سطوح انرژی بالاتر، اوربیتال های اتمی را با کمترین سطح انرژی موجود پر می کنندبر اساس اصل آفبا، الکترونها در ابتدا، اوربیتالهایی با کمترین انرژی را پر میکنند. این امر بدین معناست که الکترونها تنها زمانی به اوربیتالهایی با انرژی بالاتر وارد میشوند که اوربیتالهای با انرژی کمتر، به طور کامل پر شده باشند.
با استفاده از قانون (n+l)، ترتیب افزایش انرژی اوربیتالها مشخص میشود. به عبارت دیگر، مجموع اعداد کوانتومی اصلی و فرعی، انرژی اوربیتال را مشخص میکند.مقادیر کمتر (n+l)، متناظر با انرژی پایینتر اوربیتال هستند. اگر دو اوربیتال، مقادیر یکسان از (n+l) را داشته باشند، اوربیتالی با n کمتر، انرژی پایینتری دارد.$1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p,\\ 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p, …$موارد استثنا در اصل آفبا
آرایش الکترونی عنصر کروم طبق اصل آفبا به صورت ناصحیح زیر خواهد بود:$[Ar] 3d^4 4s^2$
شکل صحیح آرایش الکترونی کروم به صورت زیر است:
$[Ar] 3d^5 4s^1$۲ عامل اصلی را برای این نوع آرایش الکترونی;که در زیر اوردم
پایداری بیشتر اوربیتال نیمهپر $3d^5$ نسبت به $3d^4$
اختلاف کمتر انرژی بین زیرلایههای 3d و 4s
اختلاف انرژی بین زیرلایههای مختلف در تصویر زیر آورده
s، p، d، f و غیره نام هایی هستند که به اوربیتال هایی که الکترون ها را در اتم ها نگه می دارند داده می شود. این اوربیتالها شکلها و انرژیهای مختلفی دارند (مثلاً توزیع چگالی الکترون در فضا) و انرژی (مثلاً 1s انرژی کمتری نسبت به 2s است که انرژی کمتری نسبت به 3s دارد؛ 2s انرژی کمتری از 2p است).یک اتم هیدروژن با یک الکترون با 1s1 نشان داده می شود - یک الکترون در مدار 1s خود دارد.
یک اتم لیتیوم با 3 الکترون $\ce{1s^2~2s^1}$ خواهد بود
فلوئور دارای 9 الکترون است که $\ce{1s^2~2s^2~2p^5}$ خواهد بود
باز هم، همانطور که از چپ به راست می خوانیم، انرژی اوربیتال افزایش می یابد و بالانویس تعداد الکترون های اوربیتال را نشان می دهد.
تخمین انرژی نسبی اوربیتال های اتمی می توان دستگاه بسیار ساده ای ساخت. ترکیب های مجاز اعداد کوانتومی n و l در یک جدول سازماندهی شده اند، همانطور که در شکل زیر نشان داده شده است و فلش ها در زوایای 45 درجه به سمت گوشه سمت چپ پایین جدول کشیده شده اند.
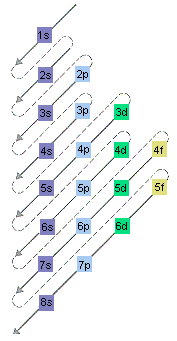
سپس ترتیب افزایش انرژی اوربیتال ها با دنبال کردن این فلش ها خوانده می شود و از بالای خط اول شروع می شود و سپس تا خطوط دوم، سوم، چهارم و غیره ادامه می یابد. این نمودار ترتیب افزایش انرژی زیر را برای اوربیتال های اتمی پیش بینی می کند.
$1s < 2s < 2p < 3s < 3p <4s < 3d <4p < 5s < 4d < 5p < 6s < 4f < 5d < 6p < 7s < 5f < 6d < 7p < 8s$ ...
اساساً توزیع الکترون ها بر روی پوسته های مختلف (سطوح انرژی) به گونه ای است که انرژی کلی همه الکترون های یک اتم برای پایداری اتم حداقل باقی می ماند.
توزیع الکترون در سطوح مختلف انرژی توسط قوانین زیر کنترل می شود:
حداکثر تعداد الکترون ها در هر سطح انرژی اصلی (پوسته) با "$2n^2 $ به دست می آید، که در آن، n یک عدد صحیح است و نشان دهنده "عدد کوانتومی اصلی" است.$F - 1s2 2s2 2px2 2py1 2pz2$

یک نوع اوربیتال 's' وجود دارد. کروی است. بنابراین یک اوربیتال s فقط می تواند 2 الکترون را در خود نگه دارد.
سه نوع اوربیتال "p" وجود دارد. آنها یک شکل هستند (مانند یک دمبل) اما در جهت های مختلف - در امتداد محورهای x، y و z قرار گرفته اند. بنابراین یک اوربیتال 'p' می تواند 2x3 = 6 الکترون را در خود جای دهد.
پنج نوع اوربیتال 'd' (10 الکترون) و هفت نوع اوربیتال 'f' (14 الکترون) وجود دارد.
اوربیتال ها را به ترتیب زیر پر کنید (به دنبال فلش های قرمز) که مرتبه افزایش انرژی است. کمترین انرژی ابتدا پر می شود.
مداری
$1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p$
پس بیایید گوگرد را مثال بزنیم.
تعداد کل الکترون ها 16 است. آنها را به روش زیر توزیع می کنیم.
$1s^2, 2s^2, 2p^6, 3s^2, 3p^4$ که در آن بالانویس های هر اوربیتال نشان دهنده تعداد الکترون های موجود در آن است. در حال حاضر، ما در مجموع 6 الکترون در آخرین مدار (3) داریم. بنابراین عدد ظرفیت 6 است.
در هنگام نوشتن پیکربندی الکترونیکی، این فقط 2 عدد آخر نیست.
برای فسفر، ما داریم:$1s^2, 2s^2, 2p^6, 3s^2, 3p^3$ که به ما 5 الکترون در بیرونی ترین مدار (3) می دهد.
برای لیتیوم (3 الکترون) داریم:$1s^2, 2s^1$که مجموعاً 3 به ما می دهد. بیرونی ترین مدار مدار دوم است و تعداد کل الکترون های موجود در آن فقط یک است. بنابراین ظرفیت لیتیوم یک است.
با این حال، انجام آن به روشی که در بالا نشان دادم مانند سدیم بسیار ساده تر است. لازم نیست همه اوربیتال ها را وارد کنید
برای اسپین، فقط به یاد داشته باشید که قبل از شروع به قرار دادن الکترونهای اسپین پایین، باید کل اوربیتال را با الکترونهای اسپین بالا پر کنید. فقط بالا و پایین را متناوب نکنید.
بیایید در مورد اوربیتال 'p' صحبت کنیم. هر «نوع» اوربیتال p باید قبل از اضافه کردن اسپین پایین دارای الکترونهای اسپین بالا باشد. بنابراین قبل از شروع به اضافه کردن الکترونهای اسپین پایین، 3 الکترون به سمت بالا وجود خواهد داشت. همچنین، نمیتوانید بدون پر کردن کامل مدار قبلی با تعداد مساوی چرخش بالا و پایین، به اوربیتال بعدی بروید.
برای فسفر؛ فرض کنید اوربیتال های 1s، 2s و 2p را پر کرده ایم. حالا یک چرخش بالا به 3 ها اضافه می کنیم و به دنبال آن یک چرخش پایین می آوریم. که ما را با 3 الکترون دیگر به مدار ظرفیت اضافه می کند (سوم). این یک اوربیتال 'p' است که باید 3 الکترون اسپین بالا داشته باشد تا بتواند الکترون های پایین اسپین را در خود جای دهد. اما فقط 3 تا مونده! بنابراین همه الکترون های رو به بالا در مدار ظرفیت خواهند بود. بنابراین کل چرخش +3/2 خواهیم داشت.
برای مثال، پیکربندی الکترونیکی عنصر بور را می توان به صورت زیر نوشت:
$1s^2 2s^2 2p^1$
با این حال، می توان آن را با در نظر گرفتن اوربیتال های مختلف p با دقت بیشتری نوشت:
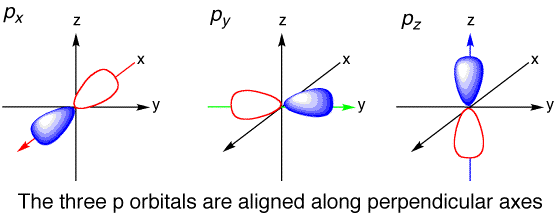 پیکربندی الکترونیکی با اوربیتالهای p مختلف که از بور در عدد اتمی صعود میکنند:
پیکربندی الکترونیکی با اوربیتالهای p مختلف که از بور در عدد اتمی صعود میکنند:$B - $1s^2 2s^2 2px^1
$C - $1s^2 2s^2 2px^1 2py^1
$N - $1s^2 2s^2 2px^1 2py^1 2pz^2
$O -$ 1s^2 2s^2 2px^2 2py^1 2pz^2
$F - $1s^2 2s^2 2px^2 2py^1 2pz^2
هر نوع اوربیتال p می تواند حداکثر 2 الکترون را در خود جای دهد. اما نحوه انتساب آنها که اوربیتال همیشه سیستماتیک نیست، به عنوان مثال. الکترونها منتظر نمیمانند تا اوربیتال pX پر شود تا بتوان اوربیتال بعدی را پر کرد (میدانم که این ربطی به سطوح انرژی و روند جدول تناوبی دارد).
آیا کسی می تواند به من بگوید این چگونه کار می کند و چگونه می توانم از آن استفاده کنم تا بتوانم تنظیمات الکترونیکی برای اوربیتال های p بنویسم. استفاده از جمع px + py + pz = pX بسیار ساده تر است. الکترون ها قبل از اینکه هر کدام به تنهایی توسط قانون حداکثر کثرت هوند اشغال شود در اوربیتال ها جفت نمی شوند. نوشتن px، py، pz به طور کامل یا استفاده از نماد p^n (n=عدم الکترون در یک اوربیتال p) یک موضوع زمینه و شرایط است تا قرارداد استاندارد. ممکن است هنگام توضیح پیوند از طریق هیبریداسیون از «نسخه کامل» استفاده کنید، اما در حین بیان پیکربندی الکترونیکی یک اتم به طور کلی، آن را حذف کنید. هر دو نماد کاملاً قابل تعویض هستند.
امیدوارم خیلی پیچیده نباشد، اما در واقع سعی کرده ام آن را تا حد امکان کوتاه کنم.


